Đề thi học kì 1 môn Hóa 9 năm 2016 - THPT Mai Xuân Thưởng
10/12/2016 13:26 pm
Trường Mai Xuân Thưởng tổ chức kỳ thi học kỳ 1 cho các em học sinh lớp 9 môn Hóa, các em tham khảo bên dưới đây:
I/ TRẮC NGHIỆM KHÁCH QUAN (3 điểm ) – Thời gian 12 phút
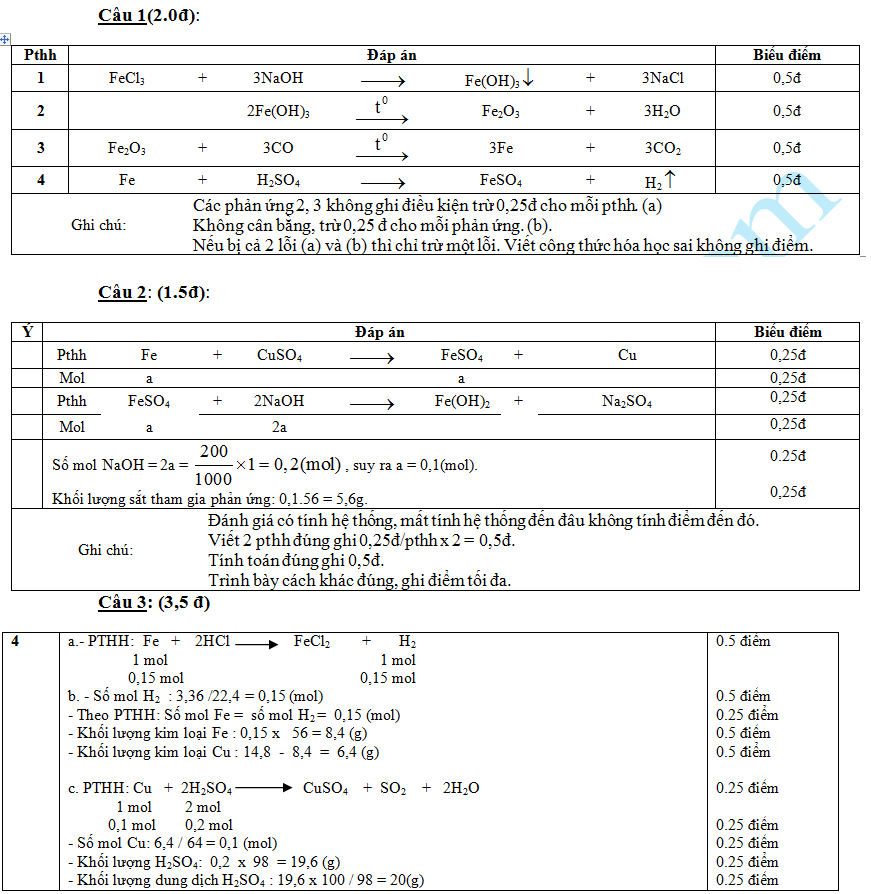
II/ PHẦN TỰ LUẬN (7 điểm) Thời gian: 33 phút Câu 1: (2 điểm)Viết phương trình hoá học theo dãy chuyển đổi hóa học sau (ghi rõ điều kiện phản ứng – nếu có):
Câu 2: (1,5 điểm) Cho một lượng sắt phản ứng vừa đủ với dung dịch đồng (II) sunfat. Thêm 400ml dung dịch NaOH 0,5M vào dung dịch sau phản ứng để kết tủa hết muối sắt tạo ra. 1. Viết các phương trình hóa học của các phản ứng xảy ra. 2. Tính khối lượng sắt tham gia phản ứng. Câu 3: ( 3,5 điểm) Cho 14,8 gam hỗn hợp 2 kim loại Cu, Fe vào dung dịch HCl dư, thu được 3,36 lít khí (đktc).
( Cho : Cu = 64, Fe = 56, O = 16, H = 1, S = 32, Cl = 35,5) Đáp ánI. TRẮC NGHIỆM: Mỗi ý đúng 0.25 điểm
Tuyensinh247.com DÀNH CHO 2K11 - LỘ TRÌNH ÔN THI VÀO LỚP 10 Tham khảo Khoá học lớp 9 - Lộ trình UP10 tại Tuyensinh247: Xem thêm thông tin và nhận tư vấn miễn phí - TẠI ĐÂY |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Viết bình luận: Đề thi học kì 1 môn Hóa 9 năm 2016 - THPT Mai Xuân Thưởng
- Đề thi thử TN THPT lần 1 năm 2026 môn Hóa - Cụm chuyên môn số 10 Hải Phòng (03/02/2026)
- Nội dung ôn tập giữa kì 2 Văn lớp 10 - THPT Trần Phú-Hoàn Kiếm 2026 (21/01/2026)
- Nội dung ôn tập giữa kì 2 lớp 10 môn Anh 2026 - THPT Trần Phú-Hoàn Kiếm (21/01/2026)
- Đề thi học kì 1 lớp 7 môn KHTN 2025 - THCS Phú An (15/01/2026)
Tin tức mới nhất
- Thí sinh dưới 15 điểm thi tốt nghiệp không được vào Đại học
- Thông tin tuyển sinh Đại học Công nghiệp TPHCM 2026
- Thông tin tuyển sinh Đại học Kinh tế luật - ĐHQGHCM 2026
- Thông tin tuyển sinh Đại học Ngoại thương năm 2026
- Chỉ tiêu tuyển sinh vào các trường Quân đội năm 2026 - Hệ dân sự
- Chính thức giới hạn 15 nguyện vọng xét tuyển Đại học 2026