Đề thi thử đại học môn Hóa khối A năm 2014 THPT Ninh Giang – Hải Dương
21/06/2014 20:31 pm
Các em tham khảo đề thi thử đại học môn Hóa khối A năm 2014 trường THPT Ninh Giang – Hải Dương mới nhất.
Đề thi thử đại học môn Hóa khối A năm 2014 trường THPT Ninh Giang – Hải DươngCâu 1: Hỗn hợp X gồm K và Al. Cho m (g) X tác dụng với H2O dư thu được 0,4 mol H2. Cho m (g) X tác dụng với dung dịch KOH dư thu được 0,475 mol H2. Xác định giá trị của m? A. 15,55 B. 14,55 C. 15,45 D. 14,45 Câu 2: Dung dịch H2S để lâu trong không khí sẽ có hiện tượng: A. Vẩn đục màu đen B. Vẩn đục màu vàng C. Cháy D. Không có hiện tượng gì Câu 3: Từ NH2(CH2)6NH2 và một chất hữu cơ X có thể điều chế tơ Nilon-6,6. CTCT của X là: A. CHO(CH2)4CHO B. HOOC(CH2)6COOH C. HOOC(CH2)4COOH D. HOOC(CH2)5COOH Câu 4: Dung dịch X chứa NaOH 1M và Ba(OH)2 0,02M. Hấp thụ 0,5 mol khí CO2 vào 500 ml dung dịch X. Hỏi thu được bao nhiêu gam kết tủa? A. 39,4 B. 19,7 C. 1,97 D. 3.94 Câu 5: Có 4 chất: Axit axetic, Glixerol, ancol Etylic, Glucozơ. Chỉ dùng thêm chất nào sau đây để nhận biết? A. Cu(OH)2/OH- B. Quỳ tím C. CaCO3 D. CuO Câu 6: Cho 5,6 gam Fe và 6,4 gam Cu vào một cốc đựng dung dịch H2SO4 loãng, rất dư. Sau khi H2 bay ra hết, tiếp tục thêm NaNO3 dư vào cốc. Số mol khí NO (sản phẩm khử duy nhất) tối đa có thể bay ra là: A. 0,1/3 B. 0,4/3 C. 0,2/3 D. 0.1 Câu 7: Trong phòng thí nghiệm, người ta thường điều chế Clo bằng cách A. Cho dung dịch HCl đặc tác dụng với MnO2, đun nóng. B. Điện phân nóng chảy NaCl. C. Cho F2 đẩy Cl2 ra khỏi dung dịch NaCl. D. Điện phân dung dịch NaCl có màng ngăn. Câu 8: Cho 50ml dung dịch FeCl2 1M vào dung dịch AgNO3 dư, khối lượng kết tủa thu được sau phản ứng là bao nhiêu gam. (Cho biết cặp oxi hoá - khử Fe3+/Fe2+ đứng trước Ag+/Ag). A. 18,15 gam B. 19,75 gam C. 15,75 gam D. 14,35 gam Câu 9: Cặp ancol nào sau đây khi đun với H2SO4 đặc, 1700C chỉ tạo ra 1 Anken duy nhất và không có sản phẩm hữu cơ khác? A. CH3OH và C2H5OH B. CH3-CH(CH3)-CH2-OH và (CH3)3-C-CH2-OH C. CH3-CH2–CH2- CH2-OH và CH3-C(CH3)2-OH D. CH3-CH2-CH2-OH và CH3-CH(OH)-CH3 Câu 10: Phát biểu nào sau đây không đúng? A. Phèn chua có công thức K2SO4.Al2(SO4)3.24H2O B. Phân đạm cung cấp Nitơ hoá hợp cho cây dưới dạng ion nitrat và ion amoni C. Supephotphat đơn chứa hàm lượng P2O5 cao hơn Supephotphat kép vì thành phần của nó chỉ chứa Ca(H2PO4)2 D. Phân urê có công thức là (NH2)2CO Câu 11: Nguyên tử của nguyên tố X tạo được oxit cao nhất là R2O5. Phần trăm khối lượng của R trong hợp chất với Hiđro là 82,353%. Nguyên tố R là: A. P B. N C. S D. Cl Câu 12: Cho một miếng Fe vào cốc đựng H2SO4 loãng. Bọt khí H2 sẽ bay ra nhanh hơn khi thêm vào cốc trên dung dịch nào trong các dung dịch sau: A. HgSO4 B. Na2SO4 C. Al2(SO4)3 D. MgSO4 Câu 13: Cho dung dịch HCl có pH=3. Hỏi phải pha thêm thể tích H2O bao nhiêu lần so với thể tích dung dịch ban đầu để có được dung dịch HCl có pH=5? A. 999 B. 100 C. 1000 D. 99 Câu 14: Có một loại oxit sắt dùng để luyện gang. Nếu khử oxit sắt này bằng Cacbon oxit ở nhiệt độ cao, người ta thu được 0,84 gam Sắt và 0,448 lít khí CO2 (đktc). Công thức hoá học của loại oxit sắt nói trên là: A. Fe3O4 B. Fe2O4 C. FeO D. Fe2O3 Câu 15: Trong các chất sau: Anđehit axetic, anlyl clorua, đường Glucozơ, Metyl axetat, đường Saccarozơ, tinh bột. Số chất tham gia phản ứng thuỷ phân là: A. 2 B. 4 C. 5 D. 3 Câu 16: Những kim loại nào sau đây có thể được điều chế theo phương pháp nhiệt luyện (bằng chất khử CO) từ oxit kim loại tương ứng là: A. Fe, Ni B. Al, Cu C. Ca, Cu D. Mg, Fe Câu 17: Đốt cháy hoàn toàn m gam hỗn hợp X gồm 2 Anđehit no đơn chức mạch hở thu được 0,4 mol CO2. Mặt khác, hiđro hoá hoàn toàn cùng lượng hỗn hợp X ở trên cần 0,2 mol H2 và thu được hỗn hợp 2 ancol. Đốt cháy hoàn toàn hỗn hợp 2 ancol trên thì thu được số mol H2Olà: A. 0,6 B. 0,8 C. 0,4 D. 0,2 Câu 18: Yếu tố nào sau đây không ảnh hưởng đến cân bằng phản ứng này : CO2 (k) + H2 (k) A. Áp suất B. Nồng độ sản phẩm C. Nồng độ các chất D. Nhiệt độ Câu 19: Cho hỗn hợp X gồm hai Ancol đa chức, mạch hở, thuộc cùng dãy đồng đẳng. Đốt cháy hoàn toàn hỗn hợp X, thu được 13,2 gam CO2 và 7,2 gam H2O. Hai Ancol đó là: A. C2H5OH và C4H9OH B. C2H4(OH)2 và C3H6(OH)2 C. C3H5(OH)3 và C4H7(OH)3 D. C2H4(OH)2 và C4H8(OH)2 Câu 20: Este X có CTPT C7H12O4, khi cho 16 gam X tác dụng vừa đủ với 200 gam dung dịch NaOH có nồng độ 4% thì thu được một ancol Y và 17,8 gam hỗn hợp 2 muối. CTCT thu gọn của X là công thức nào dưới đây? A. C2H5COOCH2CH2CH2OOCH B. CH3COOCH2CH2CH2OOCCH3 C. HCOOCH2CH2CH2CH2OOCCH3 D. CH3COOCH2CH2OOCC2H5 Câu 21: Cho Glucozơ lên men thành Ancol etylic. Toàn bộ khí CO2 sinh ra trong quá trình này được hấp thụ hết vào dung dịch Ca(OH)2 dư tạo ra 50 gam kết tủa, biết hiệu suất quá trình lên men đạt 80%. Vậy khối lượng Glucozơ cần dùng là A. 56,25 gam B. 20 gam C. 33,7 gam D. 90 gam Câu 22: Cho luồng khí CO đi qua ống sứ đựng m gam Fe2O3 ở nhiệt độ cao một thời gian, người ta thu được 6,72 gam hỗn hợp gồm 4 chất rắn khác nhau. Đem hoà tan hoàn toàn hỗn hợp rắn này vào dung dịch HNO3 dư tạo thành 0,448 lít khí NO (đktc). Giá trị m là: A. 8,2 B. 8 C. 7,2 D. 6,8 Câu 23: Dung dịch X chứa 0,1 mol NaCl và 0,15 mol NaF. Cho dung dịch X tác dụng với dung dịch AgNO3 dư. Kết tủa sinh ra có khối lượng là: A. 19,05 gam B. 14,35 gam C. 28,7 gam D. 33,4 gam Câu 24: Số đồng phân của amin ứng với CTPT C3H9N là: A. 3 B. 2 C. 4 D. 1 Câu 25: Cation R2+ có cấu hình electron ở phân lớp ngoài cùng là 2p6 . Cấu hình electron của nguyên tử R là A. 1s22s22p4 B. 1s22s22p5 C. 1s22s22p63s2 D. 1s22s22p63s1 Câu 26: Xà phòng hoá 26,4 gam hỗn hợp 2 Este CH3COOC2H5 và HCOOC3H7 bằng dung dịch NaOH vừa đủ. Số gam NaOH đã tham gia phản ứng là: A. 15 B. 12 C. 8 D. 18 Câu 27: Chỉ dùng nước, có thể phân biệt các chất trong các dãy sau: A. Na, Al, Zn, Mg B. Na, Mg, Al, Al2O3 C. Na, Zn, ZnO, Al2O3 D. Ba, Al, Fe, Mg Câu 28: Cho Mg vào dung dịch chứa FeSO4 và CuSO4. Sau phản ứng thu được chất rắn X chỉ có 1 kim loại và dung dịch Y chứa 2 muối. Phản ứng kết thúc khi nào? A. CuSO4 và FeSO4 hết, Mg dư B. FeSO4 dư, CuSO4 chưa phản ứng, Mg hết. C. CuSO4 hết, FeSO4 chưa tham gia phản ứng, Mg hết. D. CuSO4 dư, FeSO4 chưa phản ứng, Mg hết. Câu 29: Đốt cháy hoàn toàn một Hiđrocacbon X thu được 0,11 mol CO2 và 0,132 mol H2O. Khi X tác dụng với khí Clo (theo tỉ lệ số mol 1:1) thu được một sản phẩm hữu cơ duy nhất. Tên gọi của X là: A. 2-Metylpropan B. 2,2-Đimetylpropan C. 2-Metylbutan D. Etan Câu 30: Trong số các Este mạch hở C4H6O2: HCOO-CH=CH-CH3 (1) HCOO-CH2-CH=CH2 (2) HCOO-C(CH3)=CH2 (3) CH3COO-CH=CH2 (4) CH2=CH-COO-CH3 (5) Các Este có thể điều chế trực tiếp từ Axit và ancol là: A. (2) và (4) B. (2) và (5) C. (1) và (3) D. (3) và (4) Câu 31: Hỗn hợp X gồm 0,02 mol C2H2 và 0,03 mol H2 vào bình kín có Ni là xúc tác. Nung bình một thời gian được hỗn hợp Y. Cho Y lội qua dung dịch Br2 dư thấy bình Br2 tăng m gam và có 448 ml khí Z bay ra (đktc). Biết dZ/H2 = 4,5. Giá trị của m là: A. 4gam B. 0,62g C. 0,58g D. 0,4g Câu 32: So sánh nhiệt độ sôi của các chất sau: Ancol etylic (1), Etyl clorua (2), Đietyl ete (3) và Axit axetic (4). A. (4) > (3) > (2) > (1 ) B. (1 ) > (2) > (3) > (4) C. (1) > (2) > (3) > (4) D. (4) > (1) > (3) > (2) Câu 33: Điện phân 100ml dung dịch CuSO4 0,2M với cường độ dòng điện I=9,65A. Tính khối lượng Cu bám vào catôt sau khoảng thời gian điện phân là t1=200 giây và t2=500 giây (giả thiết hiệu suất phản ứng điện phân là 100%, toàn bộ kim loại sinh ra đều bám vào catot). A. 0,64 gam và 1,6 gam B. 0,32 gam và 0,64 gam C. 0,32 gam và 1,28 gam D. 0,64 gam và 1,28 gam Câu 34: Cho 14 gam hỗn hợp gồm Etanol và Phenol tác dụng vừa đủ với 100 ml dung dịch NaOH 1M . Thành phần % khối lượng của mỗi chất có trong hỗn hợp ban đầu là A. 32, 86 % và 67,14 % B. 33 % và 67 % C. 61,8 % và 38,2 % D. 32,9% và 67,1% Câu 35: Dẫn khí NH3 vào dung dịch chứa CuSO4 và Al2(SO4)3 đến dư thì: A. Xuất hiện kết tủa trắng và kết tủa xanh lam, sau đó kết tủa xanh lam tan B. Xuất hiện kết tủa trắng và kết tủa xanh lam sau đó kết tủa trắng tan C. Xuất hiện kết tủa trắng và kết tủa xanh lam D. Xuất hiện kết tủa trắng Câu 36: Dãy nào sau đây được sắp xếp theo trật tự số oxi hoá của Oxi tăng dần? A. F2O H2O O3 H2O2 B. H2O H2O2 O3 F2O C. F2O O3 H2O2 H2O D. H2O2 H2O O3 F2O Câu 37: Đốt cháy hoàn toàn 17,6 gam một Axit cacboxylic no đơn chức X được sản phẩm cháy là CO2 và H2O. Cho toàn bộ sản phầm cháy vào bình đựng dung dịch Ca(OH)2 dư thấy tạo được 80 gam kết tủa và khối lượng dung dịch trong bình giảm so với khối lượng dung dịch Ca(OH)2 ban đầu là 30,4 gam. Xác định số đồng phân cấu tạo của X? A. 1 B. 4 C. 3 D. 2 Câu 38: Trộn 0,54 gam bột Al với hỗn hợp bột Fe2O3 và CuO rồi tiến hành phản ứng nhiệt nhôm ở nhiệt độ cao trong điều kiện không có không khí thu được hỗn hợp rắn X. Hoà tan X trong dung dịch HNO3 thu được 0,896 lít (đktc) hỗn hợp khí Y gồm NO2 và NO. Tỉ khối của X so với H2 là: A. 20 B. 22 C. 23 D. 21 Câu 39: Chất làm đổi màu được giấy quỳ ẩm là: A. Phenol B. Anilin C. Đimetyl amin D. Glyxin Câu 40: Rót từ từ 250 ml dung dịch CH3COOH 1M vào 200 ml dung dịch K2CO3 1M sau khi phản ứng hoàn toàn thu được V lít khí ở đktc. V có giá trị? A. 1,008 B. 1,12 C. 0,896 D. 1,344 Câu 41: Đốt cháy hoàn toàn 0,02 mol hơi 1 Axit no, đơn chức, mạch hở trong 0,1 mol O2, thu được hỗn hợp khí và hơi X. Cho X qua H2SO4 đặc, thấy còn 0,09 mol khí không bị hấp thụ. Axit có công thức là: A. HCOOH B. CH3COOH C. C3H7COOH D. C2H5COOH Câu 42: Hỗn hợp X gồm hai kim loại kiềm có cùng số mol. Hoà tan 2,3 gam X trong 50 gam nước thu được 52,2 gam dung dịch. Hai kim loại kiềm đó là: A. Li và Rb B. Na và K C. Li và K D. Li và Na Câu 43: X là một a-aminoaxit chứa một nhóm –NH2 và một nhóm –COOH. Cho 8,9 gam X tác dụng với HCl dư thu được 12,55 gam muối. Công thức cấu tạo của A là: A. H2NCH2CH2COOH B. CH3CH2CH(NH2)COOH C. CH3CH(NH2)COOH D. CH3CH(NH2)CH2COOH Câu 44: Cho H2SO4 trung hoà 6,84 gam một Amin đơn chức X thu được 12,72 gam muối. Công thức của Amin X là: A. C2H5NH2 B. C3H7NH2 C. C3H5NH2 D. CH3NH2 Câu 45: Hợp chất hữu cơ X tác dụng được với dung dịch NaOH, dung dịch NaHCO3 và làm mất màu dung dịch Brom. Tên gọi của X là: A. Metyl metacrylat B. Phenol C. Axit metacrylic D. Axit axetic Câu 46: Cho phương trình hoá học: FexOy + HNO3 à Fe(NO3)3 + NO2 + H2O. Sau khi cân bằng phương trình hoá học trên với hệ số của các chất là những số nguyên tối giản thì hệ số của HNO3 là: A. 3x+2y B. 6x+2y C. 3x-2y D. 6x-2y Câu 47: Crackinh V (lít) Butan với hiệu suất 75% được hỗn hợp X là 5 Hiđrocacbon. Đốt cháy hoàn toàn X, cần vừa đủ 2,6 mol O2. V (lít) Butan ở đktc có giá trị là: A. 11,2 B. 8,96 C. 5,6 D. 6,72 Câu 48: Nitro hoá Benzen thu được 2 chất X, Y hơn kém nhau 1 nhóm –NO2. Đốt cháy hoàn toàn 19,4 gam hỗn hợp X, Y thu được CO2, H2O và 2,24 lít N2(đktc). CTCT đúng của X, Y là: A. C6H5NO2 và C6H4 (NO2)2 B. C6H5NO2 và C6H3 (NO2)3 C. C6H3 (NO2)3 và C6H2(NO2)4 D. C6H4 (NO2)2 vàC6H3 (NO2)3 Câu 49: Cho m gam Fe tác dụng với dung dịch HNO3 thấy sinh ra 0,1 mol NO là sản phẩm khử duy nhất của HNO3 và còn lại 1,6 gam Fe không tan. Giá trị của m là: A. 5,6 B. 7,2 C. 8,4 D. 10 Câu 50: Dãy mà tất cả các chất đếu thực hiện được phản ứng với AgNO3 trong NH3 là: A. Axetilen, Anđehit axetic, Saccarozơ B. Etanol, Glucozơ, Metyl fomiat C. Axetilen, glucozơ, Axit focmic D. Metanol, Phenol, Glucozơ
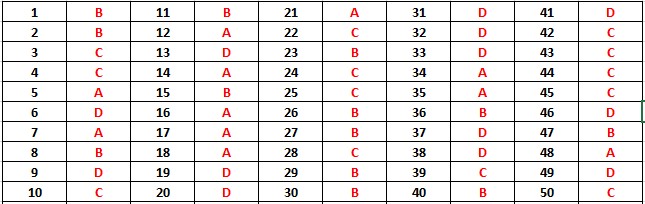
----------- HẾT ---------- Đáp án đề thi thử đại học môn Hóa khối A năm 2014 trường THPT Ninh Giang – Hải Dương
Các em chú ý theo dõi các đề thi thử đại học môn Hóa các khối A, B năm 2014 tiếp theo trên Tuyensinh247. Nguồn: Trường THPT Ninh Giang - Hải Dương
NẮM CHẮC KIẾN THỨC, BỨT PHÁ ĐIỂM 9,10 LỚP 1 - LỚP 12 CÙNG TUYENSINH247! Nếu em đang:
Tuyensinh247 giúp em:
Xem thêm thông tin khoá học & Nhận tư vấn miễn phí - TẠI ĐÂY |
>> Đề thi thử đại học môn Hóa khối A, B lần 3 trường THPT chuyên Vĩnh Phúc năm 2014 - có đáp án
>> Đề thi thử đại học môn Hóa khối A, B năm 2014 lần 2 THPT chuyên Lê Quý Đôn Quảng Trị
>> Đề thi thử đại học môn Hóa khối A,B có đáp án năm 2014 - THPT Nguyễn Du
Viết bình luận: Đề thi thử đại học môn Hóa khối A năm 2014 THPT Ninh Giang – Hải Dương
- Đề thi thử TN THPT 2026 môn Địa - THPT Lê Viết Thuật (05/03/2026)
- Đề thi thử vào lớp 10 năm 2026 môn Toán - THCS Hưng Dũng lần 1 (05/03/2026)
- Đề thi thử TN THPT lần 2 năm 2026 môn Địa - Cụm 13 trường THPT Hải Phòng (05/03/2026)
- Đề thi thử TN THPT năm 2026 môn Văn - Liên trường THPT Nghệ An (05/03/2026)
Tin tức mới nhất
- Thông tin tuyển sinh trường Sĩ quan chính trị năm 2026
- Danh sách trường công bố đề án tuyển sinh 2026 - Mới nhất
- Thông tin tuyển sinh Đại học Mỹ thuật Công nghiệp Hà Nội 2026
- Nghiên cứu khả năng mở phân hiệu đại học Hàn Quốc tại Việt Nam
- Danh sách trường Đại học xét học bạ THPT 2026 - Mới nhất
- Thông tin tuyển sinh trường Đại học Hoa Sen 2026