Đề thi thử đánh giá tư duy Bách khoa số 2 - Phần Khoa học/Giải quyết vấn đề
12/10/2023 17:29 pm
Đề thi thử đánh giá tư duy Đại học Bách khoa Hà Nội số 2 phần Tư duy Khoa học/Giải quyết vấn đề của ban chuyên môn Tuyensinh247, xem toàn bộ đề thi phía dưới.
|
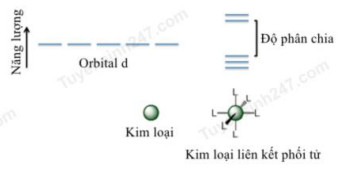
NỘI DUNG BÀI THI BIÊN SOẠN: BAN CHUYÊN MÔN TUYENSINH247.COM Đọc bài đọc sau trả lời các câu hỏi từ câu 1 – 14: Các electron của một nguyên tử bao quanh hạt nhân và nằm trong quỹ đạo nguyên tử. Trong các kim loại chuyển tiếp như sắt (Fe) và cobalt (Co) thì các electron lớp ngoài cùng nằm ở orbital d. Đối với một kim loại tự do, những orbital d có năng lượng bằng nhau. Tuy nhiên, ngay khi các phối tử (phân tử hoặc ion) liên kết với nguyên tử kim loại trung tâm, các electron trên orbital d (hoặc f) của ion kim loại sẽ bị phối tử đẩy và tiến hành phân tách năng lượng thành 2 mức: cao hơn so với mức năng lượng cơ bản và thấp hơn so với mức năng lượng cơ bản. Hiệu năng lượng của orbital d “cao” và orbital d “thấp” được gọi là thông số tách năng lượng (Hình 1).
Các nhà khoa học thực hiện một số thí nghiệm để xác định sự ảnh hưởng của các yếu tố khác nhau ảnh hưởng như thế nào đến mức độ phân tách. Họ thấy rằng điện tích của ion kim loại, vị trí của kim loại trong bảng tuần hoàn (dù nó nằm ở chu kỳ 4, 5 hay 6) hay bản chất của phối tử đều là những yếu tố quan trọng. Kết quả của các nhà khoa học được tóm tắt trong Bảng 1. Lưu ý rằng giá trị của thông số tách càng lớn đồng nghĩa với việc các electron bị phân tách càng mạnh.
Câu 1. Phát biểu nào sau đây được hỗ trợ bởi dữ liệu được trình bày trong Bảng 1? A. Phối tử F- và NH3 gây ra sự phân tách năng lượng gần như giống nhau. B. Phối tử H2O gây ra sự phân tách năng lượng nhỏ hơn so với F-. C. Phối tử F- gây ra sự phân tách năng lượng lớn hơn so với CN-. D. Phối tử CN- gây ra sự phân tách năng lượng lớn hơn so với H2O. Câu 2. Một phức chất X(NH3)63+ chưa biết được thử nghiệm và giá trị thông số tách của nó được tìm thấy là 33,900 cm-1. Dựa vào dữ liệu Bảng 1, kim loại trong phức chất này rất có thể nằm ở chu kỳ ................ Câu 3. Xem xét Bảng 1, yếu tố nào sau đây khác nhau giữa thí nghiệm 1 và thí nghiệm 3? A. Vị trí của kim loại trong bảng tuần hoàn. B. Điện tích của ion kim loại trong phức chất. C. Số lượng phối tử được thử nghiệm. D. Phối tử được thử nghiệm. Câu 4. Số phối trí của một phức chất đề cập đến số lượng phối tử được gắn vào nguyên tử kim loại trung tâm (tất cả các hợp chất được liệt kê trong Bảng 1 đều có số phối trí là 6). Cho rằng số phối trí thấp hơn có xu hướng gây ra sự phân tách năng lượng nhỏ hơn, giá trị nào sau đây có thể là thông số tách của Cr(H2O)42+? A. 16,000 cm-1. B. 12,000 cm-1. C. 21,000 cm-1. D. 14,500 cm-1. Câu 5. Phát biểu sau đây đúng hay sai? Nếu thay Fe hoặc Co bằng kim loại nhóm IA thì vẫn cho hiện tượng phân tách tương tự Câu 6. Cr, V, H2O, NH3, càng lớn, càng nhỏ Với kim loại ............ khi cùng kết hợp với một phối tử ..............., kim loại có hoá trị ............ thì sự phân tách càng lớn Câu 7. Phức chất của kim loại nào có sự phân tách năng lượng bị ảnh hưởng bởi yếu tố phối tử? A. Cr. B. Co. C. V. D. Rb. Đọc bài đọc sau trả lời các câu hỏi từ câu 8 – 15: Ở dạng tinh chế, sắt là một kim loại sáng bóng, màu xám bạc; tuy nhiên, khi sắt tinh chế tiếp xúc với điều kiện khí quyển trong một thời gian dài, bề mặt của nó trở nên bong tróc, rỗ và có màu đỏ hoặc cam. Quá trình này được gọi là " sự rỉ sét" và chất bong tróc, màu cam hoặc đỏ mới được gọi là "rỉ sét". Dưới đây, hai nhà khoa học thảo luận về cách hình thành rỉ sét và thành phần của rỉ sét. Nhà khoa học 1: Cả nước và oxygen đều cần thiết để hình thành rỉ sét. Nước là môi trường điện li, có nghĩa là nó cho phép các ion di chuyển bên trong nó. Trong môi trường tự nhiên, khi một số vật liệu bằng sắt tiếp xúc với nước, nó sẽ phân ly thành ion sắt (Fe2+) và các electron tự do. Ngoài ra, khi oxygen trong khí quyển (O2) hòa tan trong nước, một số phân tử O2 phản ứng với nước để tạo thành các ion hydroxide (OH-). Vì trong nước các ion được di chuyển tự do, ion sắt và ion hydroxide kết hợp với nhau để tạo thành một hợp chất mới: hydroxide sắt. Tuy nhiên, sắt hydroxide không phải là một hợp chất ổn định. Theo thời gian, khi nước bay hơi, nó chuyển thành dạng oxide sắt ngậm nước. Đây là “rỉ sét”. Muối có thể đóng vai trò là chất xúc tác cho sự hình thành rỉ sét, nghĩa là chúng làm tăng tốc độ hình thành rỉ sét. Tuy nhiên, rỉ sét có thể hình thành trong nước tinh khiết, trong trường hợp không thêm muối. Tăng nhiệt độ môi trường làm tăng tốc độ hình thành rỉ sét. Ngoài ra, việc tăng diện tích bề mặt sắt tiếp xúc với nước cũng làm tăng tốc độ hình thành rỉ sét. Tuy nhiên, vì bản thân lớp rỉ sét là một lớp xốp và rỗng sẽ tạo điều kiện cho nước và oxygen có thể vào sâu bên trong cấu trúc của miếng sắt để tiếp tục quá trình tạo rỉ sét. Nhà khoa học 2: Sự tấn công của acid gây ra rỉ sét. Trong nước, acid ion hóa để tạo ra các ion H+ tích điện dương và các anion tích điện âm. Các ion H+ thiếu điện tử; vì điều này, chúng thu hút các electron từ sắt. Điều này tạo ra các ion sắt (Fe2+), hòa tan trong nước. Sau khi hòa tan trong nước, các ion sắt phản ứng với oxygen hòa tan trong khí quyển (O2) để tạo ra oxide sắt hoặc rỉ sét. Acid có thể đến từ nhiều nguồn khác nhau. Ví dụ, khi carbon dioxide trong khí quyển hòa tan trong nước, acid carbonic (H2CO3) được tạo ra. Acid carbonic là nguyên nhân phổ biến nhất của rỉ sét. Tuy nhiên cũng tồn tại các nguồn acid môi trường khác như nước mưa, thường có tính acid nhẹ vì nó đã hoà tan sulfur dioxide (SO2) và nitrogen oxide (NxOy), tạo ra acid tương ứng. Ngoài ra, bản thân sắt có thể chứa các tạp chất như phosphor (P) và lưu huỳnh, cũng phản ứng với nước để tạo ra acid. Như vậy, cả môi trường acid và các tạp chất trong sắt đều là điều kiện khiến sắt bị gỉ. Có thể ngăn ngừa rỉ sét bằng cách sơn bảo vệ bề mặt sắt để ngăn sắt tiếp xúc với nước, oxygen và acid. Sắt cũng có thể được bảo vệ thông qua biện pháp "mạ kẽm", bao gồm việc phủ lên sắt một lớp kẽm mỏng. Vì kẽm hoạt động mạnh hơn sắt nên nó bị ăn mòn trong khi sắt được bảo vệ. Câu 8. Một chiếc đinh sắt được đặt trong một bình nước đã được đun sôi để giải phóng hết oxi hòa tan. Bình được gắn vào một máy bơm chân không để loại bỏ không khí bên trong nó. Sau đó, bình được niêm phong. Giả sử lời giải thích của Nhà khoa học 1 là đúng, kết quả nào sau đây sẽ được quan sát? A. Oxide sắt ngậm nước sẽ hình thành trên bề mặt của đinh sắt. B. Không có oxide sắt ngậm nước sẽ hình thành trên bề mặt của đinh sắt. C. Oxygen sẽ tích tụ bên trong bình. D. Các ion hydroxide sẽ được tạo ra trong dung dịch. Câu 9. Cho rằng tất cả những điều sau đây đều đúng, điều nào sau đây, nếu được tìm thấy, cung cấp bằng chứng mạnh nhất chống lại giả thuyết của Nhà khoa học 1? A. Khi nồng độ của các ion hydroxide trong dung dịch tăng lên, gỉ sắt hình thành ít nhanh hơn trong dung dịch. B. Khi muối ăn được hòa tan trong nước, nước có khả năng dẫn điện tốt hơn. C. Khi hòa tan muối ăn trong nước, tốc độ tạo ra ion Fe2+ tăng lên. D. Trong trường hợp không có nước lỏng, sắt không bị gỉ. Câu 10. Cho rằng tất cả những điều sau đây đều đúng, điều nào sau đây, nếu được tìm thấy, cung cấp bằng chứng mạnh nhất chống lại giả thuyết của Nhà khoa học 2? A. Khi một miếng sắt rỉ sét được ngâm trong nước cốt chanh (acid citric), nó sẽ sáng bóng trở lại. B. Khi một chiếc đinh sắt được ngâm trong nước trong một thùng chứa mở, rỉ sét sẽ hình thành trên chiếc đinh ngay cả khi không thêm acid. C. Khi hai chiếc đinh sắt được ngâm trong dung dịch acid và nước giống hệt nhau, chúng sẽ bị gỉ với tốc độ khác nhau. D. Khi không cho oxi hòa tan vào dung dịch chứa miếng sắt thì miếng sắt không bị gỉ. Câu 11. Sodium hydroxide (NaOH) là một base trung hòa acid. Giả sử rằng dung dịch kiềm được thêm vào nước có nhúng một ống sắt. Theo Nhà khoa học 2, tốc độ rỉ sét của đường ống rất có thể sẽ … Câu 12. Theo Nhà khoa học 1, điều kiện nào sau đây sẽ dẫn đến sự hình thành rỉ chậm nhất? A. Cho một thanh sắt vào nước ở 30°C. B. Cho bột sắt vào nước ở 5°C. C. Cho một thanh sắt vào nước ở 5°C. D. Cho bột sắt vào nước ở 30°C và thêm muối ăn.
DÀNH CHO 2K8 – ÔN THI ĐÁNH GIÁ NĂNG LỰC 2026!Bài thi Đánh giá năng lực 2026 thay đổi toàn bộ từ cấu trúc bài thi, các dạng câu hỏi,.... mà bạn chưa biết phải ôn tập như thế nào cho hiệu quả? không học môn đó thì làm bài ra sao? Bạn cần phương pháp ôn tập và làm bài thi từ những người am hiểu về kì thi và đề thi? Bạn cần thầy cô đồng hành suốt quá trình ôn luyện? Vậy thì hãy xem ngay lộ trình ôn thi bài bản tại ON.TUYENSINH247.COM:
Xem thêm thông tin khoá học & Nhận tư vấn miễn phí - TẠI ĐÂY |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Viết bình luận: Đề thi thử đánh giá tư duy Bách khoa số 2 - Phần Khoa học/Giải quyết vấn đề
Tin tức mới nhất
- Danh sách trường công bố đề án tuyển sinh 2026 - Mới nhất
- Thông tin tuyển sinh Đại học Mỏ địa chất 2026
- Thông tin tuyển sinh trường Đại học Sư phạm nghệ thuật Trung Ương 2026
- Thông tin tuyển sinh Đại học Lâm nghiệp 2026
- Thông tin tuyển sinh Học viện Kỹ thuật và Công nghệ an ninh 2026
- Thông tin tuyển sinh Đại học Phòng cháy chữa cháy 2026